肝内胆管癌(Intrahepatic cholangiocarcinoma,iCCA)占原发性肝癌的10%~15%,是仅次于肝细胞癌(Hepatocellular carcinoma,HCC)的第二大常见肝脏原发恶性肿瘤,其发病率在全球范围内逐年上升[1]。iCCA恶性程度高,预后极差,患者术后5年生存率仅25%~40%,远差于HCC[2]。由于iCCA具有非常强的肿瘤间及肿瘤内异质性,这加剧了其对放化疗、靶向治疗或免疫治疗的耐受,也使得不同患者间的治疗响应差异较大[3, 4]。因此,深入认识并阐明iCCA的肿瘤异质性并对其进行更精确的分子分型是提高患者治疗反应率的重要手段。
当前,世界卫生组织已经发现iCCA内存在两个主要亚型:即起源于靠近肝门部胆管上皮细胞的大胆管型和起源于外周胆管上皮细胞的小胆管型[5]。进一步的研究证实这两种iCCA亚型无论在驱动基因突变、组织学形态以及患者临床预后等方面均存在巨大差异,提示从肿瘤起源上进行iCCA的分子分型对于肿瘤的个体化治疗具有重要意义[6]。然而,公认肿瘤学标志物的缺乏以及很大部分iCCA(约32.4%)的组织学形态不典型,影响并阻碍了人们对iCCA起源上分型的认识[7]。
2022年3月28日,复旦大学附属中山医院樊嘉院士/高强教授、北京大学数学科学学院席瑞斌研究员、中国科学院上海巴斯德所张晓明研究员课题组合作在 Nature Communications 上发表了题为“Single-cell transcriptomic analysis suggests two molecularly subtypes of intrahepatic cholangiocarcinoma”的研究。该研究基于单细胞转录组测序找到并鉴定出大、小胆管iCCA的特异性肿瘤标志物,并揭示了两种不同iCCA亚型在临床预后、肿瘤微环境特征、细胞起源等方面的差异,对深入认识iCCA肿瘤异质性及其个体化精准治疗提供理论依据。

大胆管型iCCA主要由靠近肝门部的柱状黏液胆管细胞组成。既往研究发现该型iCCA往往发生于原发性硬化性胆管炎、肝吸虫感染或肝内胆管结石背景下。相比小胆管型iCCA,该亚型具有更高频率的KRAS、TP53基因突变,患者淋巴结转移率更高,预后更差[8, 9]。前期学者基于基因测序及组织染色研究,发现钙结合蛋白质S100P在该亚型特异性高表达,是潜在的特异性肿瘤标志物[10]。S100P属于S100家族,在胰腺癌、结直肠癌、前列腺癌以及肺癌等多种恶性肿瘤中高表达,与肿瘤的发生、侵袭转移等密切相关。相对于大胆管型,小胆管型iCCA至今仍未鉴定出有效的肿瘤标志物。有研究发现N-cadherin、NCAM在小胆管型iCCA中表达水平升高,然而由于其阳性表达率低,区分大、小胆管的效力显著低于S100P,因此难以成为小胆管型iCCA的首选肿瘤标志物[11]。
为了从肿瘤起源角度探索大、小胆管不同亚型iCCA的肿瘤异质性及肿瘤微环境特征,研究团队开展了14例iCCA的单细胞转录组测序研究(图1a)。通过SingleR、拷贝数变异、上皮细胞评分等对细胞类型进行了注释,获得了包括肿瘤细胞及非肿瘤细胞在内的共计144,878个细胞(图1b-d)。
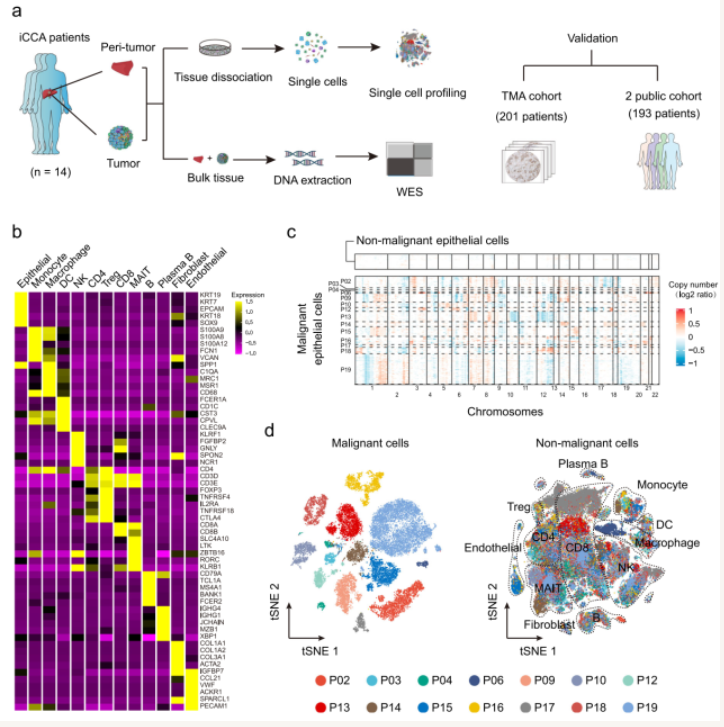
图1 单细胞转录组测序解析iCCA肿瘤微环境组成及特征
(图源:Song GH, et al. , Nat Commun , 2022)
通过对数据中的肿瘤细胞进一步分析发现,来源于大胆管型iCCA的肿瘤细胞显著高表达S100P(图2a),而小胆管型iCCA肿瘤细胞特异性高表达SPP1,两者呈现显著互斥(图2b, c)。进一步在大样本队列以及蛋白表达水平上的验证,结果显示S100P和SPP1是有效区分大、小胆管型iCCA的肿瘤标志物(图2d),生存曲线结果显示,S100P+SPP1-大胆管型iCCA患者的临床预后显著差于S100P-SPP1+小胆管型(图2e),并且其具有更高的CA19-9、CEA、Ki67水平,但具有更小的肿瘤体积(图2f)。
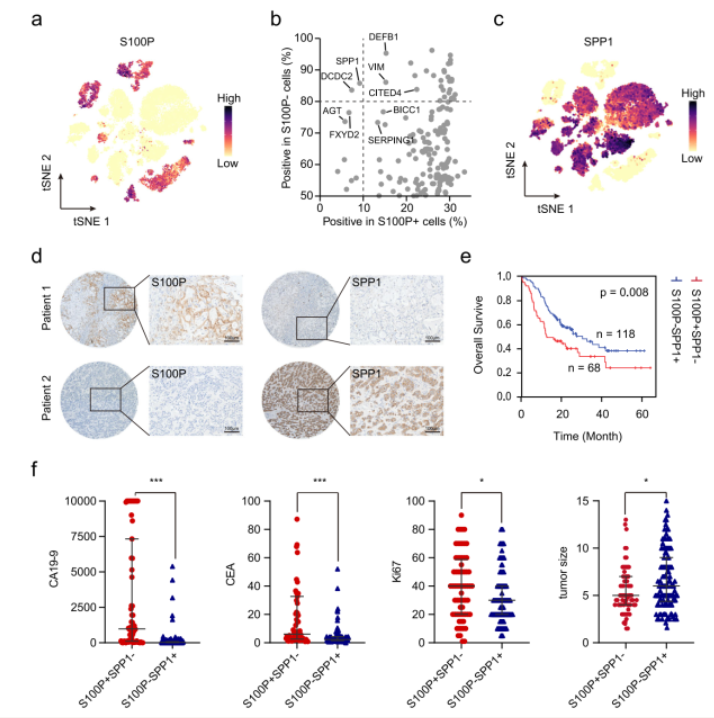
图2 S100P和SPP1是大、小胆管型iCCA特异性肿瘤标志物
(图源:Song GH, et al. , Nat Commun , 2022)
大胆管型iCCA肿瘤细胞转录本异质性显著高于小胆管型iCCA,并且两类肿瘤细胞表现出不同的信号通路激活及功能特征(图3a, b)。单细胞基因调控网络分析(SCENIC)结果显示大胆管型iCCA细胞中更显著富集转录因子CREB3L1及其下游靶基因,并且能够调控S100P基因表达(图3c, d),进一步的双荧光素酶报告实验及细胞功能学证实CREB3L1能够调控S100P基因转录并促进iCCA肿瘤细胞迁移(图3e-g)。
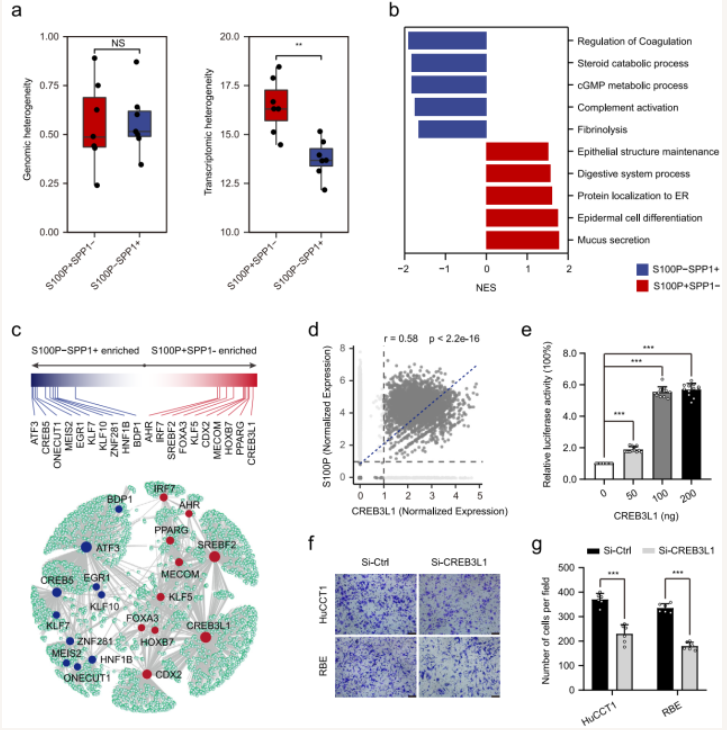
图3 大胆管型和小胆管型iCCA肿瘤细胞转录调控差异
(图源:Song GH, et al. , Nat Commun , 2022)
对两类iCCA肿瘤免疫微环境分析及探索,发现大胆管型iCCA富集更多的CCL18+ 巨噬细胞、更少的CD3+ T细胞、CD4+ T细胞以及CD56+ NK细胞,而小胆管型iCCA富集更多的SPP1+ 巨噬细胞,提示大胆管型iCCA具有更显著的肿瘤免疫抑制微环境(图4)。
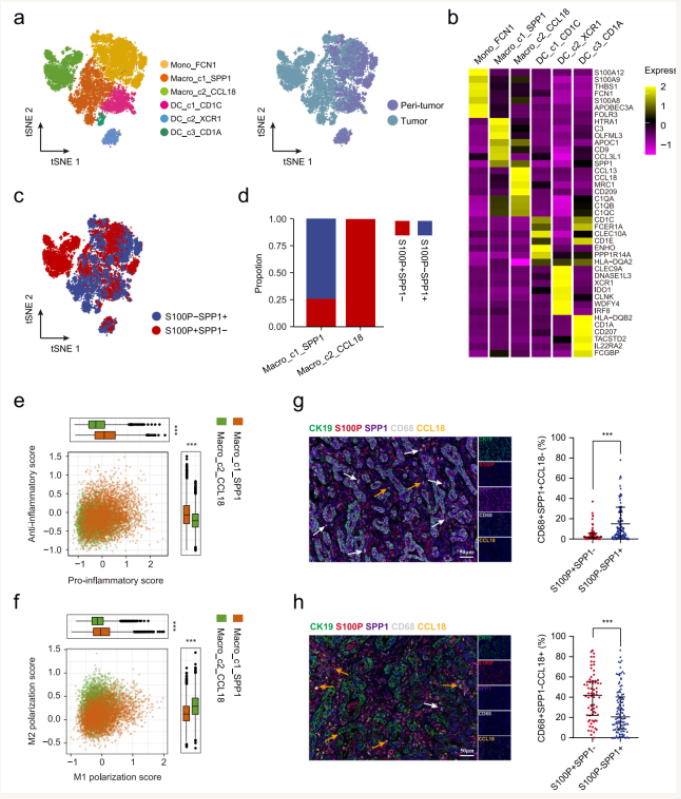
图4 大胆管型和小胆管型iCCA中不同巨噬细胞亚群分布差异
(图源:Song GH, et al. , Nat Commun , 2022)
此外,该研究还发现小胆管型iCCA中还特异性存在ALB+ 肝细胞分化样肿瘤细胞,该类肿瘤细胞高表达肝细胞相关标志物;而ALB- 肿瘤细胞则高表达干细胞相关标志物,如ID3、ID4、MDK、LGR5等,提示小胆管型iCCA中存在不同分化阶段的肿瘤细胞(图5)。
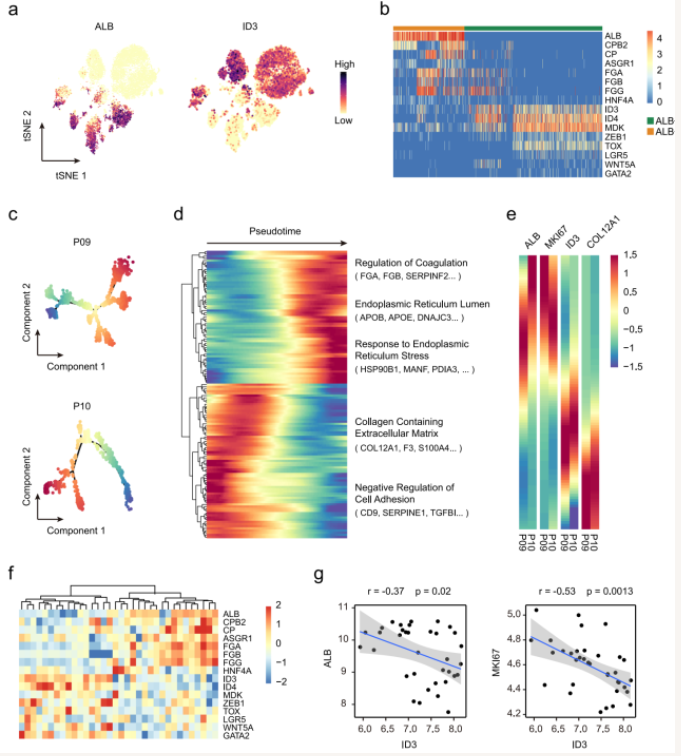
图5小胆管型iCCA中存在不同分化阶段的肿瘤细胞
(图源:Song GH, et al. , Nat Commun , 2022)
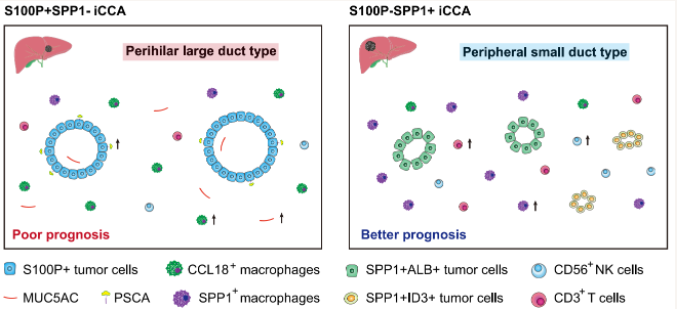
图6工作总结图:大、小胆管不同亚型iCCA肿瘤异质性及微环境特征
(图源:Song GH, et al. , Nat Commun , 2022)
综上所述, 该研究基于单细胞转录组测序首次发现并提出SPP1是小胆管型iCCA的特异性肿瘤标志物,与大胆管型iCCA肿瘤标志物S100P的表达水平结合,能够有效的将iCCA患者区分为S100P+SPP1-大胆管型和S100P-SPP1+小胆管型两种亚型;研究同时探索了两种亚型iCCA在肿瘤细胞组成特征、转录调控、肿瘤免疫微环境以及临床病理特征等方面的不同,对iCCA的基础研究与临床个体化治疗提供新思路(图6)。该研究还发现转录因子CREB3L1能够调控S100P基因表达,并促进iCCA肿瘤细胞迁移,或许是大胆管型iCCA潜在治疗靶点,需后续研究进一步证明。此外,关于iCCA的肿瘤细胞起源问题非常复杂,除了肝内大、小胆管细胞,部分iCCA也能够起源于肝细胞或肝母细胞,这些不同细胞起源的iCCA在形态、功能和分子结构上具有很大的不同,因此,从小鼠iCCA模型出发或许为其肿瘤细胞起源问题带来更深入的见解。
原文链接:https://www.nature.com/articles/s41467-022-29164-0
复旦大学附属中山医院高强教授及樊嘉院士、北京大学数学科学学院席瑞斌研究员、中国科学院上海巴斯德所张晓明研究员为该文共同通讯作者。复旦大学附属中山医院宋国贺博士、北京大学数学科学学院石阳博士、中国科学院上海巴斯德所孟璐副研究员及马家强博士为该文共同第一作者。该研究得到了国家自然科学基金委、上海市科委以及中国科学院前沿科学重点研究项目等基金的资助。
参考文献:
1.Valle JW, Kelley RK, Nervi B, Oh DY, Zhu AX. Biliary tract cancer. Lancet 2021, 397(10272): 428-444.
2.Mazzaferro V, Gorgen A, Roayaie S, Droz Dit Busset M, Sapisochin G. Liver resection and transplantation for intrahepatic cholangiocarcinoma. J Hepatol 2020, 72(2): 364-377.
3.Ma L, Wang L, Khatib SA, Chang CW, Heinrich S, Dominguez DA, et al. Single-cell atlas of tumor cell evolution in response to therapy in hepatocellular carcinoma and intrahepatic cholangiocarcinoma. J Hepatol 2021, 75(6): 1397-1408.
4.Dong LQ, Shi Y, Ma LJ, Yang LX, Wang XY, Zhang S, et al. Spatial and temporal clonal evolution of intrahepatic cholangiocarcinoma. J Hepatol 2018, 69(1): 89-98.
5.Nagtegaal ID, Odze RD, Klimstra D, Paradis V, Rugge M, Schirmacher P, et al. The 2019 WHO classification of tumours of the digestive system. Histopathology 2020, 76(2): 182-188.
6.Kendall T, Verheij J, Gaudio E, Evert M, Guido M, Goeppert B, et al. Anatomical, histomorphological and molecular classification of cholangiocarcinoma. Liver Int 2019, 39 Suppl 1: 7-18.
7.Hayashi A, Misumi K, Shibahara J, Arita J, Sakamoto Y, Hasegawa K, et al. Distinct Clinicopathologic and Genetic Features of 2 Histologic Subtypes of Intrahepatic Cholangiocarcinoma. Am J Surg Pathol 2016, 40(8): 1021-1030.
8.Banales JM, Marin JJG, Lamarca A, Rodrigues PM, Khan SA, Roberts LR, et al. Cholangiocarcinoma 2020: the next horizon in mechanisms and management. Nat Rev Gastroenterol Hepatol 2020, 17(9): 557-588.
9.Komuta M, Govaere O, Vandecaveye V, Akiba J, Van Steenbergen W, Verslype C, et al. Histological diversity in cholangiocellular carcinoma reflects the different cholangiocyte phenotypes. Hepatology 2012, 55(6): 1876-1888.
10.Rhee H, Ko JE, Chung T, Jee BA, Kwon SM, Nahm JH, et al. Transcriptomic and histopathological analysis of cholangiolocellular differentiation trait in intrahepatic cholangiocarcinoma. Liver Int 2018, 38(1): 113-124.
11.Hayashi A, Misumi K, Shibahara J, Arita J, Sakamoto Y, Hasegawa K, et al. Distinct Clinicopathologic and Genetic Features of 2 Histologic Subtypes of Intrahepatic Cholangiocarcinoma. Am J Surg Pathol 2016, 40(8): 1021-1030.
撰文:宋国贺


